Органические и неорганические вещества входящие в состав клетки. Неорганические вещества
Познакомившись с химическими элементами, содержащимися в живых организмах, обратимся к изучению веществ, в состав которых эти элементы входят. Среди них выделяют неорганические (вода, минеральные соли и кислоты) и органические соединения (рис. 1). Больше всего по массе в живых организмах содержится воды.
Вода. Содержание воды в живых организмах составляет 60—75 % их массы, а у некоторых, например медуз, — до 98 %. В листьях и сочных плодах растений содержание воды также может достигать 98 %.
Количество воды неодинаково в разных тканях и органах. Так, у человека в сером веществе головного мозга ее содержание составляет 85 %, а в костной ткани — 22 %. Наибольшее содержание воды в организме наблюдается в эмбриональный период (95 %) и с возрастом постепенно уменьшается. Без употребления воды человек может прожить не более 5—7 дней.
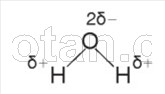
Как вы уже знаете из курса химии, молекула воды (Н 2 0) состоит из двух атомов водорода, соединенных ковалентными полярными связями с атомом кислорода.
Связи Н—О—Н расположены под углом 104,5° друг к другу. Кислород обладает большей электроотрицательностью, чем водород, поэтому атом кислорода притягивает к себе общие электронные пары и приобретает частично отрицательный заряд. Атомы водорода приобретают частично положительный заряд, т. е. молекула воды является полярной.
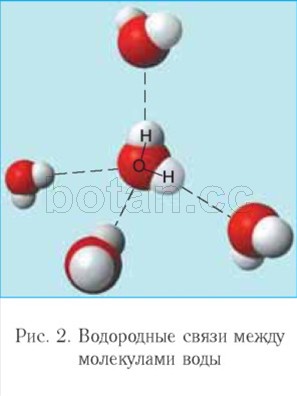
Между атомом кислорода одной молекулы воды и атомом водорода другой молекулы возникает электростатическое притяжение. Такое взаимодействие,
более слабое, чем ионная связь, называется водородной связью. Каждая молекула воды, подобно маленькому магниту, притягивает к себе за счет образования водородных связей еще четыре молекулы (рис. 2). Благодаря образованию водородных связей молекулы воды связаны друг с другом. Поэтому вода при температурах от О °С до 100 °С может сохранять жидкое агрегатное состояние, тогда как подобные ей водородные соединения (например, H 2 S, NH 3 , HF) являются газами.
Биологическая роль воды в живых организмах связана с ее свойствами, прежде всего с малыми размерами молекул, их полярностью и способностью образовывать водородные связи между собой и с другими соединениями.
Именно вода определяет объем клеток и внутриклеточное (тургорное) давление. Благодаря полярности молекулы воды способны формировать так называемые гидратные оболочки вокруг ионов и полярных молекул. Это способствует обособлению частиц и препятствует их склеиванию друг с другом, что особенно важно, например, для белковых молекул.
Полярность молекул и способность образовывать водородные связи делает воду универсальным растворителем для полярных веществ, лучшим, чем большинство известных жидкостей. В зависимости от растворимости в воде соединения условно делят на растворимые, или гидрофильные (от греч. гидор — вода, фшшя — люблю), и нерастворимые, или гидрофобные (от греч. фобос — страх). Гидрофильными веществами являются моно- и дисахариды, многие минеральные соли и кислоты, низшие спирты, низшие карбоновые кислоты и др. Гидрофобны высшие карбоновые кислоты, жиры и некоторые другие вещества.
Вода — это среда протекания множества обменных процессов. Большинство химических реакций в организме происходит именно в водных растворах. Поступление и выведение веществ из клетки осуществляется, как правило, в растворенном виде. Вода принимает непосредственное участие во многих химических реакциях, происходящих в клетках, в том числе в процессах расщепления органических соединений. Она является одним из исходных веществ в реакциях фотосинтеза. Кислород, образующийся в ходе фотосинтеза, выделяется при расщеплении молекул воды.
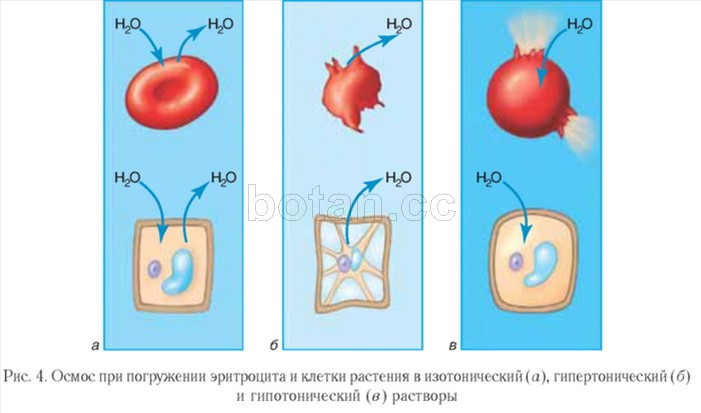
Вода как растворитель принимает участие в явлениях осмоса, играющих важную роль в жизнедеятельности клеток организма. Осмос — это перемещение молекул воды через полупроницаемую мембрану (например, через цитоплазматическую мембрану клетки) из области с меньшей концентрацией растворенных веществ (например, солей, сахаров или мочевины) в область с более высокой концентрацией этих веществ (рис. 3). За счет осмоса происходит выравнивание концентраций растворенных веществ в клетке и внеклеточной среде.
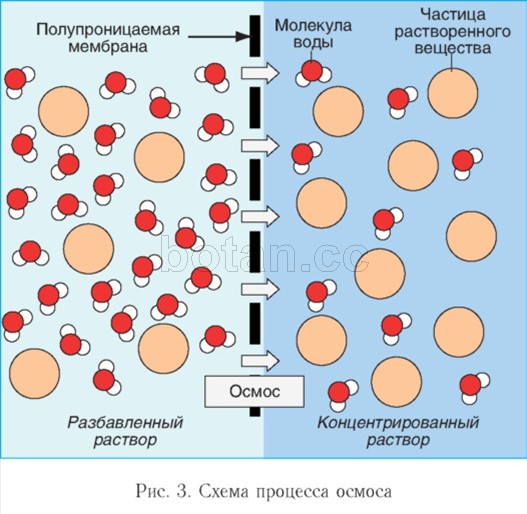
Если раствор и растворитель (например, воду) разделить избирательно проницаемой мембраной, наблюдается перемещение молекул растворителя через мембрану в раствор. Для того чтобы воспрепятствовать поступлению растворителя, к раствору необходимо приложить определенное давление, которое называется осмотическим давлением. Чем более концентрированным является раствор, тем выше его осмотическое давление.
Растворы, осмотическое давление которых такое же, как в клетках, получили название изотонических. Объем клеток, погруженных в изотонические растворы, остается неизменным (рис. 4, а). Изотонические растворы, в частности физиологический раствор (водный раствор NaCl массовой долей 0,9 %), используются в медицине. Их применяют при сильном обезвоживании и потере крови больными, для растворения лекарственных препаратов, вводимых путем инъекций.
Раствор, осмотическое давление которого выше, чем в клетках, называется гипертоническим. Клетки, погруженные в гипертонический раствор, теряют воду и уменьшаются в объеме, т. е. сморщиваются (рис. 4, б). Гипертонический раствор находит применение в лечении ран. Марлевая повязка, смоченная таким раствором, хорошо впитывает гной, что способствует очищению и заживлению раны.
Противоположная картина наблюдается при погружении клеток в гипотонический раствор, в котором концентрация растворенных веществ ниже, чем в клетках. В этом случае вода устремляется в клетку, клетка разбухает и может лизироваться, т. е. лопнуть (рис. 4, в).
С водой связана также регуляция теплового режима организмов. Воде свойственна высокая теплоемкость — способность поглощать большое количество теплоты при незначительных изменениях собственной температуры. Благодаря этому вода предотвращает резкие изменения температуры в клетках и организме в целом, даже когда температурные колебания в окружающей среде достаточно велики.
Общее количество водородных связей меязду молекулами воды изменяется в зависимости от температуры. При таянии льда разрушается примерно 15 % водородных связей, а при 40 °С — половина. При переходе в состояние пара разрушаются все водородные связи. При изменении температуры внешней среды вода поглощает (или выделяет) теплоту вследствие разрыва (или образования) многочисленных водородных связей. Этим объясняется высокая удельная теплоемкость воды.
При испарении воды организмами (транспирация у растений, потоотделение у млекопитающих) тратится много теплоты, что защищает их от перегрева.
Благодаря высокой теплопроводности вода обеспечивает равномерное распределение теплоты между тканями организма (например, через систему кровообращения). Таким образом, вода участвует в регуляции теплового режима организма.
Минеральные соли и кислоты. Для поддержания жизнедеятельности клеток и организма в целом необходимы минеральные соли. В живых организмах они находятся либо в растворенном виде (диссоциированы на ионы), либо в твердом состоянии. С биологической точки зрения наиболее важными среди ионов являются катионы К + , Na + , Са 2+ , Mgr + и анионы СГ, НСО3, НРО^, Н0РО4.
Общее содержание минеральных солей в различных клетках варьирует от одного до нескольких процентов. Их роль в клетке разнообразна. Так, разная концентрация ионов К + и Na + внутри и снаружи клеток приводит к возникновению разности электрических потенциалов на цитоплазматической мембране, что очень важно для передачи нервных импульсов, а также для транспорта веществ через мембрану. При уменьшении этой разности снижается возбудимость клеток.
Некоторые ионы необходимы для синтеза органических веществ. Например, остатки фосфорной кислоты входят в состав нуклеотидов и АТФ, ион Fe 2+ — в состав гемоглобина, Mg 2+ — в состав хлорофилла и т.д. Ионы NO3, NHJ являются источниками атомов азота, ион SO 2- — атомов серы, которые необходимы автотрофным организмам для синтеза аминокислот. Регуляторную функцию и активизацию многих ферментов осуществляют ионы Са 2+ и Mg 2+ . Кроме того, ионы Mg 2 * активизируют энергетический обмен и синтез АТФ.
Соединения кальция (например, СаС0 3) входят в состав раковин моллюсков, панцирей ракообразных и других животных. У некоторых протестов внутриклеточный скелет построен из оксида кремния (IV) Si0 2 или сульфата стронция SrS0 4 .
Неорганические кислоты также выполняют важные функции в организме. Так, в желудке позвоночных соляная кислота создает кислую среду, способствуя уничтожению болезнетворных микроорганизмов и активации ферментов желудочного сока, стимулирует сокращения стенок желудка. Угольная кислота и ее анионы формируют бикарбонатную буферную систему, а анионы фосфорной кислоты — фосфатную буферную систему.
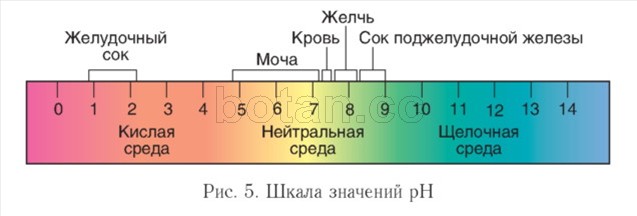
Кислотность среды. На протекание биохимических реакций в живых организмах существенное влияние оказывает концентрация ионов водорода (Н +) — кислотность среды. В нейтральных растворах эта концентрация составляет 1(Г 7 моль/л. Для характеристики кислотности среды удобно пользоваться водородным показателем рН(пэ-аш) и шк алой pH (рис. 5).
В водных растворах величина pH обычно принимает значения от 0 до 14. Нейтральная среда характеризуется значением pH = 7, в щелочной среде pH больше 7, в кислой — меньше 7. Чем больше величина pH отличается от 7, тем более кислым или щелочным является раствор.
Внутри клеток среда нейтральная или слабощелочная (pH = 7,0—7,3), в крови величина pH несколько выше, чем в клетках и обычно колеблется в пределах 7,35—7,45. В пищеварительном тракте pH сильно варьирует. Экстремальные величины pH характерны для желудка (1 —2) и тонкого кишечника (более 8). Значительные колебания pH (4,8—7,4) наблюдаются в моче.
Понятие о буферных растворах. Живые организмы в целом и их отдельные клетки обладают способностью поддерживать кислотность среды на определенном уровне. В поддержании слабощелочной реакции внеклеточной среды
участвуют угольная кислота Н 2 С0 3 и гидрокарбонат-ион НСО3. Угольная кислота — слабый электролит, в растворе определенная часть ее молекул диссоциирована и наблюдается баланс:
Н 2 С0 3 ^ Н + + НСОд.
Если по какой-либо причине концентрация ионов Н + в растворе увеличивается (среда становится более кислой), анионы НСОд связывают их:
Н + + НСО3 ->. Н 2 С0 3 .
Если кислотность среды снижается, молекулы угольной кислоты диссоциируют, высвобождая дополнительные ионы водорода:
Н 2 С0 3 Н+ + НСО3.
Так в растворе сохраняется относительно постоянная концентрация ионов Н + . Сходным образом анионы фосфорной кислоты НоРО^ и НРО^ обеспечивают поддержание нейтральной или слабощелочной среды внутри клеток. Растворы, в которых при изменении состава среды обеспечивается относительное постоянство концентрации ионов водорода (Н +), называются буферными.
1. Какие неорганические вещества входят в состав живых организмов?
2. Какие вещества называют гидрофильными? Гидрофобными? Приведите примеры.
3. Охарактеризуйте биологическую роль минеральных солей и кислот.
4. Сколько воды содержится в живых организмах? От чего это зависит? Почему растения при недостатке воды увядают?
5. Два раствора глюкозы разделены мембраной, не пропускающей молекулы глюкозы, но пропускающей воду. Концентрация глюкозы в первом растворе— 1 %, во втором — 0,1 %. Что происходит с молекулами воды? Как называется это явление?
6. Каковы основные функции воды в живых организмах? Как физические и химические свойства воды связаны с ее биологическими функциями?
7. Как вы думаете, почему большинство полярных веществ хорошо растворяются в воде, а неполярные, как правило, нерастворимы в ней?
8. Буферные свойства внеклеточной среды обеспечивают угольная кислота и гидрокар-бонат-ион, внутри клеток эту функцию выполняют анионы фосфорной кислоты. Почему эти соединения позволяют поддерживать в растворах определенную концентрацию ионов водорода, в то время как азотная и соляная кислоты, а также их анионы, не обладают такими свойствами?
- § 1. Содержание химических элементов в организме. Макро- и микроэлементы
- § 2. Химические соединения в живых организмах. Неорганические вещества
- § 10. История открытия клетки. Создание клеточной теории
- § 15. Эндоплазматическая сеть. Комплекс Гольджи. Лизосомы
Глава 1. Химические компоненты живых организмов
Глава 2. Клетка - структурная и функциональная единица живых организмов
Глава 3. Обмен веществ и преобразование энергии в организме
1. Какие неорганические вещества входят в состав живых организмов?
В состав живых организмов входят такие неорганические вещества как вода, минеральные соли, неорганические (минеральные) кислоты и некоторые другие.
2. Какие вещества называют гидрофильными? Гидрофобными? Приведите примеры.
Гидрофильными называют вещества, которые интенсивно взаимодействуют с молекулами воды с образованием водородных связей. Как правило, гидрофильные вещества хорошо растворяются в воде. Гидрофобные вещества слабо взаимодействуют с молекулами воды, «стремятся» избежать контакта с ней. Такие вещества не растворяются в воде. Для базового уровня изучения биологии достаточно, чтобы учащиеся характеризовали гидрофильные вещества как растворимые в воде, а гидрофобные – как нерастворимые в ней.
Гидрофильными веществами являются, например, моно- и дисахариды, низшие спирты, низшие карбоновые кислоты, многие неорганические кислоты и соли. К гидрофобным относятся жиры, высшие карбоновые кислоты и некоторые другие вещества.
3. Охарактеризуйте биологическую роль минеральных солей и кислот.
Нерастворимые минеральные соли входят в состав различных опорных структур живых организмов, например, карбонат кальция (CaCO 3) – в состав раковин моллюсков и панцирей ракообразных. Внутриклеточный скелет некоторых протистов построен из сульфата стронция (SrSО 4).
Растворимые минеральные соли в живых организмах находятся в виде ионов т.к. в водной среде происходит их диссоциация. С биологической точки зрения наиболее важными среди ионов являются катионы К + , Na + , Ca 2+ , Mg 2+ и анионы Cl – , НСО 3 – , НРО 4 2– , Н 2 РО 4 – . Разная концентрация ионов К + и Na + внутри и снаружи клеток приводит к возникновению разности электрических потенциалов на цитоплазматической мембране, что важно для передачи нервных импульсов и для транспорта веществ через мембрану. При уменьшении этой разности снижается возбудимость клеток. Остатки фосфорной кислоты входят в состав нуклеотидов и АТФ. Fe 2+ входит в состав гемоглобина, Mg 2+ – в состав хлорофилла. Ионы NO 3 – и NH 4 + являются источниками атомов азота, а ион SO 4 2– – атомов серы, которые необходимы автотрофным организмам для синтеза аминокислот. Ионы Са 2+ и Mg 2+ выполняют регуляторную функцию, активизируют многие ферменты. Например, ионы Mg 2+ активизируют энергетический обмен и синтез АТФ.
Минеральные (неорганические) кислоты также выполняют важные биологические функции. Соляная кислота создаёт кислую среду в желудке позвоночных животных и человека, способствуя уничтожению болезнетворных микроорганизмов и активации ферментов желудочного сока, стимулирует сокращения стенок желудка. Анионы фосфорной кислоты образуют фосфатную буферную систему, обеспечивающую поддержание нейтральной или слабощелочной среды внутри клеток. Угольная кислота и её анионы формируют бикарбонатную буферную систему, которая поддерживает слабощелочную реакцию внеклеточной среды.
4. Сколько воды содержится в живых организмах? От чего это зависит? Почему растения при недостатке воды увядают?
Содержание воды зависит от вида организма, его возраста, типа клеток (тканей) и их физиологического состояния. Например, у человека в сером веществе головного мозга содержится около 85% воды, а в костной ткани – 22%. Наибольшее содержание воды в организме наблюдается в эмбриональный период (около 95%) и с возрастом постепенно уменьшается, что приводит к снижению функциональной активности клеток, тканей и организма в целом.
Вода определяет объём клетки и внутриклеточное (тургорное) давление, вызывающее напряжённое состояние клеточной оболочки. При недостатке воды в клетках снижается тургорное давление, поэтому растения увядают.
5. Два раствора глюкозы разделены мембраной, не пропускающей молекулы глюкозы, но пропускающей воду. Концентрация глюкозы в первом растворе - 1%, во втором - 0,1%. Что происходит с молекулами воды? Как называется это явление?
Молекулы воды перемещаются через полупроницаемую мембрану из менее концентрированного раствора (с массовой долей глюкозы 0,1%) в более концентрированный раствор (с массовой долей глюкозы 1%). Это явление называется осмосом. За счёт осмоса происходит выравнивание концентраций глюкозы в растворах, разделённых полупроницаемой мембраной.
6. Каковы основные функции воды в живых организмах? Как физические и химические свойства воды связаны с её биологическими функциями?
Вода входит в состав клеток и межклеточного вещества, составляет основу крови, лимфы, тканевой жидкости, секретов желез. Она определяет объём клеток и обеспечивает поддержание тургорного давления. Вода – универсальный растворитель для полярных соединений и основная среда, в которой протекают процессы обмена веществ живых организмов. Большинство химических реакций в организме происходит именно в водных растворах. Поступление и выведение веществ из клеток осуществляется, как правило, в растворённом виде. Вода как растворитель участвует в явлениях осмоса, благодаря которому происходит выравнивание концентраций растворённых веществ в клетках и внеклеточной среде.
Вода – непосредственный участник многих биохимических реакций, например, реакций гидролитического расщепления (гидролиза) органических соединений. Она является одним из исходных веществ в реакциях фотосинтеза. Кислород, выделяющийся при фотосинтезе, образуется при расщеплении молекул воды.
Вода участвует в регуляции теплового режима организмов. Она обеспечивает равномерное распределение теплоты между тканями и органами, предотвращает резкие изменения температуры в клетках и организме в целом, даже когда температурные колебания в окружающей среде достаточно велики. При испарении воды организмами (транспирация у растений, потоотделение у млекопитающих) тратится много теплоты, что защищает их от перегрева.
Вода является универсальным растворителем и средой протекания процессов обмена веществ благодаря полярности молекул и их способности образовывать межмолекулярные водородные связи с другими соединениями. Малый размер молекул воды играет важную роль в осмотических явлениях. Участие воды в регуляции теплового режима организмов связано с её высокой теплоёмкостью, хорошей теплопроводностью и высокой теплотой парообразования. Это, в свою очередь, обусловлено способностью молекул воды образовывать между собой многочисленные водородные связи.
7. Как вы думаете, почему большинство полярных веществ хорошо растворяются в воде, а неполярные, как правило, нерастворимы в ней?
Молекулы воды полярны, что позволяет им интенсивно взаимодействовать с другими полярными веществами. Вода способствует обособлению структурных частиц полярных соединений (ионов, молекул), их переходу в раствор, образует вокруг ионов и полярных молекул гидратные оболочки.
С неполярными соединениями молекулы воды взаимодействуют очень слабо. Такие вещества практически нерастворимы в воде, но хорошо растворяются в неполярных растворителях (например, в бензине). Здесь уместно вспомнить древнее правило алхимиков: «Подобное растворяется в подобном».
8*. Буферные свойства внеклеточной среды обеспечивают угольная кислота и гидрокарбонат-ион, внутри клеток эту функцию выполняют анионы фосфорной кислоты. Почему эти соединения позволяют поддерживать в растворах определённую концентрацию ионов водорода, в то время как азотная и соляная кислоты, а также их анионы, не обладают такими свойствами?
Угольная кислота – слабый электролит. В водных растворах лишь небольшая часть её молекул диссоциирована на ионы, поэтому в межклеточной среде наряду с гидрокарбонат-ионами (НСО 3 –) содержатся и недиссоциированные молекулы угольной кислоты (Н 2 СО 3). Внутри клеток наблюдается определённый баланс (равновесие) между анионами фосфорной кислоты Н 2 РО 4 – и НРО 4 2– :
Н 2 СО 3 ↔ Н + + НСО 3 –
Н 2 РО 4 – ↔ Н + + НРО 4 2–
При снижении кислотности среды равновесие смещается вправо – высвобождаются дополнительные ионы водорода (Н +). При повышении кислотности равновесие смещается влево – происходит связывание «лишних» ионов Н + . Благодаря этому реакция внеклеточной среды (или внутриклеточного содержимого) практически не меняется.
Азотная и соляная кислоты – сильные электролиты. При растворении в воде они почти полностью диссоциируют на ионы:
HNO 3 → H + + NO 3 –
HCl → H + + Cl –
Диссоциация сильных электролитов практически необратима, поэтому их растворы не обладают буферными свойствами.
* Задания, отмеченные звёздочкой, предполагают выдвижение учащимися различных гипотез. Поэтому при выставлении отметки учителю следует ориентироваться не только на ответ, приведённый здесь, а принимать во внимание каждую гипотезу, оценивая биологическое мышление учащихся, логику их рассуждений, оригинальность идей и т. д. После этого целесообразно ознакомить учащихся с приведённым ответом.
Как мы уже знаем, клетка состоит из химических веществ органического и неорганического типа. Основными неорганическими веществами, входящими в состав клетки, являются соли и вода.
Вода как компонент живого
Вода – это доминирующий компонент всех организмов. Важные биологические функции воды осуществляются за счет уникальных свойств ее молекул, в частности наличии диполей, которые делают возможным возникновение водородных связей между клетками.
Благодаря молекулам воды в организме живых существ происходят процессы термостабилизации и терморегуляции. Процесс терморегуляции происходит за счет высокой теплоемкости молекул воды: внешние перепады температуры не влияют на температурные изменения внутри организма.
Благодаря воде органы человеческого организма сохраняют свою эластичность. Вода является одной из основных составляющих смазывающих жидкостей, необходимых для суставов позвоночных или околосердечной сумки.
Она входит в слизь, облегчающую передвижение веществ по кишечнику. Вода – составляющая желчи, слез и слюны.
Соли и другие неорганические вещества
Клетки живого организма помимо воды содержат такие неорганические вещества как кислоты, основания и соли. Наиболее важное значение в жизнедеятельности организма имеют Mg2+, H2PO4, K, CA2, Na, C1-. Слабые кислоты гарантируют стабильную внутреннюю среду клетки (слабощелочную).
Концентрация ионов в межклеточном веществе и внутри клетки может быть различной. Так к примеру ионы Na+ сконцентрированы только в межклеточной жидкости, в то время как К+ содержится исключительно в клетке.
Резкое сокращение либо повышения количества определенных ионов в составе клетке не только к ее дисфункции, но и к гибели. К примеру, снижение количества Са+ в клетке вызывает судороги внутри клетки и дальнейший ее отмирание.
Некоторые неорганические вещества часто вступают во взаимодействие с жирами, белками и углеводами. Так ярким примером являются органические соединения с фосфором и серой.
Сера, которая входит в состав молекул белка, отвечает за образование молекулярных связей организма. Благодаря синтезу фосфора и органических веществ происходит освобождение энергии с белковых молекул.
Соли кальция
Нормальному развитию костной ткани, а также функционированию головного и спинного мозга способствуют соли кальция. Обмен кальция в организме осуществляется за счет витамина D. Избыток или недостаток солей кальция влечет за собой дисфункцию организма.